2025年11月13日
岐阜大学
脳室を守る“糖のバリア”が老化や出血で壊れる仕組みを解明 ― 脳内環境恒常性維持の新たな分子基盤を提示 ―
本研究のポイント
・脳の中にある空間(脳室)の壁を構成する上衣細胞の表面を覆う、糖でできたバリアであるグリコカリックス(Gcx)は、脳実質との間で特定の分子のみを通過させる境界構造として働く可能性が示されました。
・脳の出血を再現した実験では、炎症が起こる過程で、この糖のバリアが薄くなったり剥がれ落ちたりして、脳を守る壁の表面が壊れてしまうことが観察されました。
・老化したマウスでは、糖のバリアが薄くなり剥がれやすくなっており、脳の出血後に炎症がなかなか治まらないことが確認されました。さらに、細胞一つひとつを調べる最新の解析技術により、老化した細胞では、糖のバリアを作り出すための“遺伝子情報”が書き換えられてしまっていることが明らかになりました。
研究概要
岐阜大学大学院医学系研究科脳神経外科学分野の飯田知宏医師、出雲剛教授、腫瘍病理学分野の富田弘之准教授、救急・災害医学分野の岡田英志教授らのグループは、脳の空間(脳室)の壁である上衣細胞を覆う「グリコカリックス」という糖でできたバリアが、加齢や脳の出血によって壊れてしまうことを新たに発見しました。このバリアの崩壊は、病気の原因の一つである可能性や、新たな治療法を開発する上での重要なヒントになることを示唆しています。
脳室上衣細胞の頂端面を覆うGcxは、糖鎖に富む構造であり、脳脊髄液(CSF)の循環や脳内老廃物の排出、脳内恒常性の維持に関与すると考えられています。脳の老廃物排出システムは、アルツハイマー病や睡眠関連疾患との関連で近年注目されていますが、その詳細な構造や加齢・脳損傷による変化は十分に理解されていません。
本研究では、若年マウス、老齢マウス、脳室内出血(IVH)モデルマウスを用い、上衣Gcxの形態変化と糖鎖構成をランタン強調電子顕微鏡法および21種のレクチンを用いた二重免疫蛍光染色により包括的に解析しました。若年マウスではシアル酸やガラクトース残基に富むGcxが観察されましたが、老齢マウスでは顕著な菲薄化と剥離、終末シアル酸を含む糖鎖の減少が認められました。IVH後の炎症は若年群で3日目にピークを示しましたが、老齢群では7日目も炎症が持続していることが確認され、加齢に伴う上衣Gcxの脆弱化が、出血後の炎症遷延や修復遅延の一因となる可能性が示唆されました。さらに単一細胞RNA解析により、老齢上衣細胞でシアル酸付加酵素やO-型糖鎖合成酵素の発現低下、脱シアル化酵素NEU3の上昇、および加齢・炎症関連遺伝子群の誘導が確認されました。これらの結果は、上衣Gcxが加齢および出血により構造的・代謝的に破綻し、脳室周囲炎症や水頭症、神経変性の進行に寄与する可能性を示唆します。
本研究成果は、現地時間2025年11月7日にFluids and Barriers of the CNS誌のオンライン版で発表されました。
研究背景と内容
私たちの体を構成する細胞の表面は、「グリコカリックス(Gcx)」という、糖でできた産毛のような層で覆われています。この層は、細胞と外部環境とのやり取りを調節する重要な役割を担っています。その存在自体は以前から知られていましたが、非常に壊れやすい構造であるため、詳しく観察することが長らく困難でした。近年、観察技術の進歩によりGcxを安定的に可視化できるようになり、その多様な機能が次々と明らかになるにつれて再び注目を集めています。なかでも血管内皮Gcxは、血管透過性の制御や腫瘍微小環境の形成、転移などへの関与が示され、精力的に研究が進められています。
【画像:https://kyodonewsprwire.jp/img/202511128968-O7-kns2TkoX】
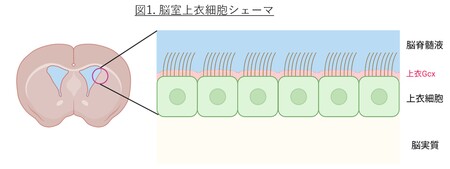
脳の中には、「脳室」と呼ばれる、液体(脳脊髄液)で満たされた部屋のような空間があります。その壁を形成しているのが「上衣細胞」という細胞です(図1)。この細胞は、表面に小さな毛のような突起を持ち、脳脊髄液を動かして、脳の中の老廃物を洗い流す“掃除係”のような働きをしています。脳室上衣細胞の頂端面(すなわちCSFと接する側)にも、糖鎖からなる被覆構造であるGcx(上衣Gcx)が存在し、上衣の物理的・化学的バリア機能や免疫応答の調節に関与すると考えられています。近年、脳の中の“ゴミ出しシステム”(脳脊髄液やリンパ管を介した老廃物の排出)の研究が、アルツハイマー病や睡眠障害などの病気との関連で大きな注目を集めています。しかし、この“ゴミ出し”に重要な役割を果たす上衣細胞や、その表面を覆う糖のバリア(Gcx)についての研究は、まだほとんど進んでいません。特に、このバリアが老化によってどう変化するのか、病気でどう壊れるのかは、ほとんど分かっていませんでした。その糖鎖プロファイルや構造的多様性、病態との関連性については血管内皮Gcxの研究に比べて理解が大きく遅れています。中枢神経系の恒常性維持や病態形成における上衣Gcxの意義を明らかにすることは、今後の重要な研究課題といえます。そこで、上衣Gcxの病的変化や加齢による変化を観察すべく、電子顕微鏡(SEM, TEM)やレクチン染色を用いて若年成体マウス、脳室内出血(IVH)モデルマウス、老齢マウスの上衣を観察しました。
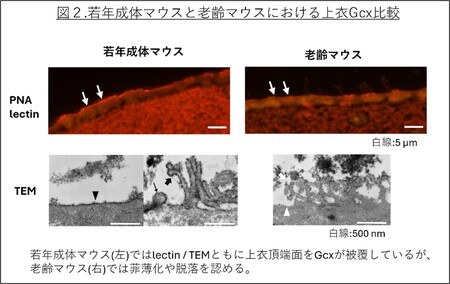
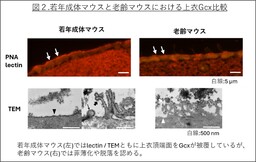
若年成体マウスでは、上衣細胞の頂端面、微絨毛、繊毛を被覆していることがTEMにより明らかになりました(図2左下)。またこれまでの報告と同様にシアル酸が豊富な糖鎖構造が確認されたと同時に、PNAの結合性も高く、シアル酸に被覆されないガラクトース末端の露出したO型糖鎖も共存することが示されました(図2左上)。この糖鎖プロファイルの多様性は血管内皮とは異なり、選択的な分子透過や界面での物質交換を担う上衣細胞の特性を反映したものと考えられます。一方、老齢マウスでは上衣Gcxが菲薄化し、場所によっては消失していることが明らかとなりました(図2右上下)。
【画像:https://kyodonewsprwire.jp/img/202511128968-O8-9r570AFP】
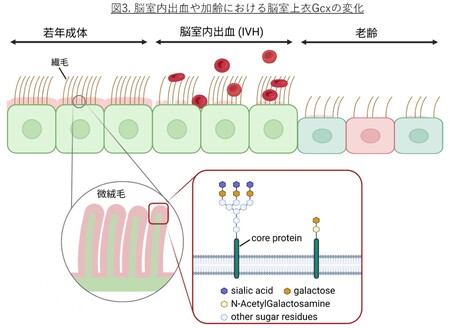
また、若年成体マウスに自己血を脳室内投与して作成した脳室内出血(IVH)モデルでは、炎症の経過に伴い上衣Gcxの損傷と回復が観察され、発症3日目に障害がピークを示しました。これに対し、老齢マウスでは7日目でも炎症が持続していることが確認され、加齢に伴うGcxの障害が出血後の炎症遷延や修復遅延の一因となる可能性が示唆されました。
【画像:https://kyodonewsprwire.jp/img/202511128968-O9-EWx894I2】
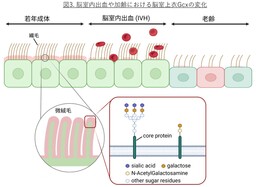
さらに、老齢マウスの上衣細胞では多くのレクチンで細胞質内の結合性が上昇しており、糖鎖の生合成・輸送・代謝経路のリモデリングが生じている可能性が考えられました。単一細胞RNA解析の結果、老齢上衣細胞ではシアル酸付加酵素(ST3GAL1、SLC35A1)およびO型糖鎖合成酵素の発現低下、脱シアル化酵素NEU3の上昇、および加齢・炎症関連遺伝子群の誘導が確認されました。これらの結果から、上衣Gcxは加齢および出血によって構造的・代謝的に破綻(図3)し、その変化が脳室周囲炎症や神経変性の進行に関与する可能性が示唆されました。
今後の展開
本研究では、上衣Gcxの形態変化に焦点を当て、その加齢や脳室内出血に伴う構造的変化を明らかにしましたが、上衣Gcx研究はまだ始まったばかりの領域です。今後は、これらの形態変化が上衣の機能障害(バリア機能の破綻や脳脊髄液循環・老廃物排出障害、神経幹細胞ニッチへの影響など)や、炎症反応にどのように結びつくのかを明らかにし、さらに上衣Gcxが治療標的となり得るかを検討する必要があります。こうした研究をさらに進めることで、この「糖のバリア(Gcx)」の故障が関わっていると考えられる水頭症、アルツハイマー病、さらには老化や睡眠に関わる病気の“これまで知られていなかった原因”の解明につながり、将来の新しい治療法の開発に役立つことが期待されます。
用語解説
1) Glycocalyx(Gcx):糖タンパク質・糖脂質・プロテオグリカンから構成される細胞表面の糖鎖層。陰性に帯電しており、物質の透過性制御や細胞間相互作用、シグナル伝達の調節など、多様な機能を担う。例えるなら、細胞にとっての「コート」のようなもので、外部の刺激から細胞を守り、必要な物質だけを取り込むフィルターの役割もします。
2) シアル酸(Sialic acid):Gcxを構成する糖鎖の末端に位置する単糖で、カルボキシル基により陰性電荷を帯びる。細胞表面の電荷バリアを形成するほか、「自己」認識や免疫寛容の維持にも重要な役割を果たす。この物質が糖のバリアの表面にあることで、静電気の力で不要なものが近づくのを防いでいます。また、免疫細胞に「これは自分の細胞だから攻撃しないで」と伝える目印にもなっています。
3) O型糖鎖(O-glycan):二大糖鎖(N型糖鎖およびO型糖鎖)の一つで、コアタンパク質のセリン(Ser)またはスレオニン(Thr)残基に付加される。構造によりCore1〜Core5に分類され、上衣細胞のGcxでは特にCore1構造の存在が確認されている。
4) 上衣細胞:脳室壁を裏打ちする一層の細胞層で頂端面には微絨毛や運動性繊毛を有する。脳実質と脳脊髄液の境界面を形成し、イオン輸送体やアクアポリンを介して水・電解質バランスを調節するとともに、CSFの対流を介して代謝老廃物の除去(glymphatic systemに関連)にも寄与する。
論文情報
雑誌名:Fluids and Barriers of the CNS
タイトル:Age Dependent and Post Intraventricular Hemorrhage Remodeling of the Ependymal Glycocalyx in Mice
著者:Tomohiro Iida#, Kosuke Mori#, Hiroyuki Tomita*, Kazufumi Ohmura, Kohtaro Taguchi, Ayumi Niwa, Tomohiro Kanayama, Shigeyuki Sugie, Hideshi Okada*, Tsuyoshi Izumo, Akira Hara
DOI:10.1186/s12987-025-00725-x